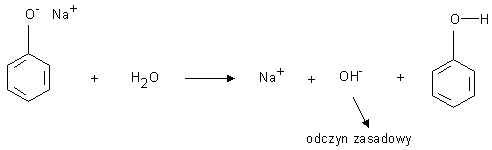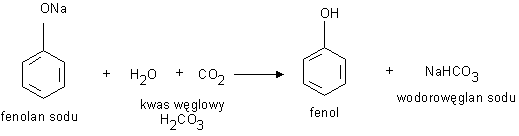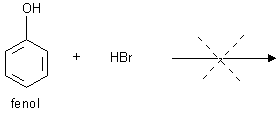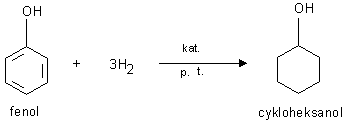Alkohole
Alkoholami nazywamy związki zawierające grupę lub grupy hydroksylowe --OH połączone z nasyconymi atomami węgla. Można je zatem uważać za pochodne węglowodorów, w których wodór podstawiony jest przez grupę wodorotlenową. Nazwy alkoholi szeregu nasyconego (Ar)R-CH2-OH wprowadza się od nazwy grupy węglowodorowej wchodzącej w skład alkoholu: alkohol metylowy, eytlowy, propylowy, benzylowy itd. Według słownictwa racjonalnego nazwę alkoholu wprowadza się z nazwy odpowiedniego węglowodoru przez dodanie końcówki -ol np. metanol, etanol, propanol. Reszta R--O-- powstała przez odłączenie wodoru z grupy hydroksylowej alkoholu nosi nazwę grupy alkoksylowej; grupę CH3O - nazywamy grupę metoksylową, C2H5O - etoksylową, ogólnie -OR alkoksylową.
Reakcję powstawania alkoholi można podzielić na dwie zasadnicze grupy. Do grupy pierwszej należą reakcje wspólne dla wszystkich alkoholi. Do najważniejszych z nich należy reakcja wymiany fluorowca w fluorowcoalkanach na grupę hydroksylową -OH za pomocą wodorotlenków, między innymi wodorotlenku srebra
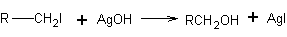
Do grupy drugiej zaliczymy reakcje specyficzne dla poszczególnych alkoholi. I tak na przykład alkohol metylowy powstaje z gazu wodnego wzbogaconego w wodór
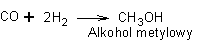
a alkohol etylowy podczas fermentacji alkoholowej cukrów lub metodą "acetylenową" (zwaną inaczej reakcją Kuczerowa)
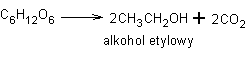
Przy podziale alkoholi na odpowiednie podgrupy uwzględniamy:
1) rodzaj łańcucha węglowego,
2) rzędowość atomów węgla,
3) liczbę grup wodorotlenowych w cząsteczce
W związku z powyższym mamy:
1) alkohole nasycone lub nienasycone
2) alkohole pierwszo-, drugo- i trzeciorzędowe
3) alkohole jedno-, dwu i wielowodorotlenowe.
Do alkoholi nasyconych należą: metanol, etanol, propanol, itd. Przykładem alkoholu nienasyconego może być alkohol allilowy CH2=CH--HC2OH.
Wśród izomerycznych alkoholi wyróżniamy trzy ich rodzaje, zeleżnie od tego czy grupa --OH znajduje się przy węglu pierwszo-, drugo- czy trzeciorzędowym. Odpowiednie alkohole noszą nazwy: pierwszorzędowego, drugorzędowego i trzeciorzędowego. Jako przykład rzędowości alkoholi mogą posłużyć różne izomeryczne butanole. Z normalnego butanu wywodzą się dwa alkohole
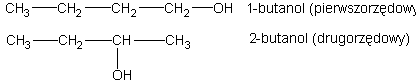
Z izobutanu (2-metylopropanu) można również wyprowadzić dwa alkohole, a mianowicie
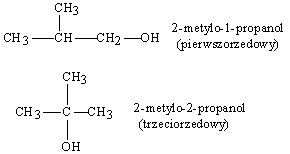
Rzędowaść alkoholi ilustrują zatem podane poniżej wzory ogólne
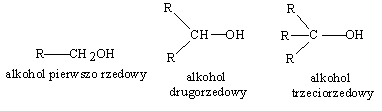
W celu odróżnienia od siebie alkoholi pierwszo-, drugo i trzeciorzędowych można wykorzystać reakcje utleniania. Alkohole pierwszorzędowe utlenianie przechodzą najpierw w aldehydy, później w kwasy o tej samej liczbie atomów węgla co utleniany alkohol
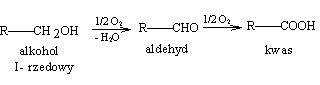
Podczas utleniania alkoholi drugorzędowych powstają ketony

Alkohole trzeciorzędowe utleniają się dość trudno, a podczas utleniania w drastycznych warunkach rozpadają się tworząc złożoną mieszaninę kwasów karboksylowych o mniejszej liczbie atomów węgla niż wyjściowy alkohol.
Oprócz alkoholi jednowodorotlenowych (zawierających jedną grup -OH w cząsteczce) mogą istnieć również alkohole dwu-, trój i wielowodorotlenowe, z tym jednak zastrzeżeniem, że przy tym samym atomie węgla nie może znajdować się więcej niż jedna grupa wodorotlenowa. Przykłaiem alkoholu dwuwodorotlenowego może być tzw. glikol zawierający w cząsteczce dwie grupy funkcyjne -OH, a alkoholu trójwodorotlenowego - gliceryna z trzema grupami -OH
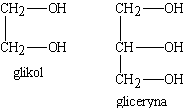
Jak już zaznaczono powyżej obecność grupy alkoholowej -OH w związkach organicznych zaznaczamy przyrostkiem -ol. Stąd alkohole wywodzące się z alkanów nazywamy alkanolami, a pochodne alkenów alkenolami. Pochodne alkanów zawierające w cząsteczkach dwie grupy alkoholowe to alkanodiole, a zawierające trzy grupy -OH - alkanotriole; ogólnie alkanopoliole. Zgodnie z powyższym glikol wywodzący się z etanu ma nazwę racjonalną etanodiol, a gliceryna - propanotriol. W przypadku dłuższego łańcucha węglowodorowego, przed podaniem liczby grup -OH należy podać numery atomów węgla, przy których znajdują się te grupy. A oto przykład takiego alkoholu
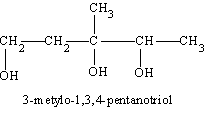
Właściwości
Niższe człony szeregu homologicznego alkoholi są cieczami, dobrze rozpuszczalnymi w wodzie. Rozpuszczalność i lotnoć alkoholi maleje szybko wraz ze wzrostem masy cząsteczkowej tak, że alkohole mające więcej niż 10 atomów węgla w cząsteczce są już w temperaturze pokojowej nierozpuszczalnymi w wodzie ciałami stałymi
Porównanie właściwosci fizycznych alkoholi z własciwościami węglowodorów o podobncj masie cząsteczkowej wskazuje na pewne uderzające różnice. Alkohole w porównamu z odpowiadającymi im węglowodorami są znacznie mniej lotne, wykazują wyższe temperatury topnienia i większą rozpuszczalność w wodzie. W miarę wzrostu masy cząsteczkowej różnice te stopniowo maleją (tabela powyżej).
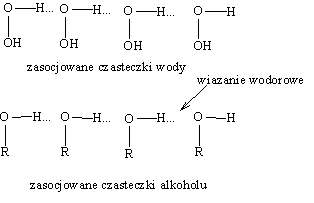
W ,,asocjatach" alkoholi i wody cząsteczki powiązane są. tzw. wiązaniami wodorowymi, które są wynikiem wzajemnego oddziaływania pary elektronowej atomu tlenu jednej cząsteczki na atom wodoru drugiej. Istnieniem asocjatów tłumaczy się fakt, że alkohole mają wyższe temperatury wrzenia niż odpowiadające im halogenki alkilowe, węglowodoy i etery, ponieważ do odparowania cząstczek alkoholu konieczny jest pewien nakład dodatkowej energii na rozerwanie wiązań wodorowych (moc wiązań wodorowych wynosi ok. 20 kJ/mol). Inaczej mówiąc, można uznać, że asocjacja wywołana utworzeniem wiązań wodorowych odpowiada zwiększonej masie cząsteczkowej, w związku z tym następuje zmniejszenie lotności.
O powinowactwie alkoholi do środowiska wodnego, decyduje grupa hydroksylowa. Stąd dobrą rozpuszczalnosć w wodzie alkoholi o niższych masach cząsteczkowych łatwo wytłumaczyć tworzeniem się wiązań wodorowych z cząsteczkami wody. Grupa wodotlenowa w metanolu i etanolu stanowi ok. połowy masy cząsteczki, tłumaczy to mieszanie się metanolu i etanolu z wodą w każdym stosunku.
W miarę wzrostu masy cząsteczkowej grupy alkilowej w alkoholu udział grupy wodorotlenowej w jej masie cząsteczki jest coraz mniejszy, co powoduje zmniejszenie rozpuszczalności w wodzie. Alkohole stałe są już w wodzie praktycznie nierozpuszcalne. Właściwości fizyczne alkoholi o dużych masach cząsteczkowych stają się podobne do właściwości odpowiednich węglowodorów.
Podobieństwo alkoholu do wody uwidacznia się rńwnież w ich właściwościach chemicznych. Podobnie jak w cząsteczce wody, wodór grupy -OH można w alkoholu podstawić atomem metalu alkalicznego
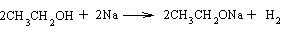
Powstają wówczas tzw. alkoholany, ogólnie alkanolany. Alkanolany są związkami nietrwałymi i istnieją tylko w środowisku bezwodnym. Pod wpływem wody (nawet pary wodnej) ulegają rozkładowi z wytworzeniem wodorotlenku i wolnego alkoholu
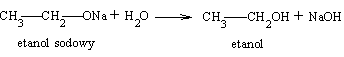
Alkohole, podobnie jak woda, wykazują właściwości amofoteryczne, są jednak bardzo słabymi kwasami i zasadami. O kwasowym charakterze alkoholi świadczy reakcja z metalami alkalicznymi. Zasadowy charakter alkoholi uwidacznia się w fakcie, że można je za pomocą mocnych kwasów przeprowadzić w bardziej lub mniej trwałe sole. Na przykład reakcja bromowodoru z metanolem daje nietrwałą sól - bromek metylooksoniowy
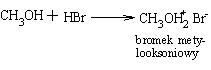
Ważną grupę związków stanowią produkty reakcji alkoholi z kwasami zwane estrami. tworzą się one w odwracalnej reakcji estryfikacji alkoholi, zarówno z kwasami nieorganicznymi jak i organicznymi. Proces estryfikacji i słownicztwo estrów wyjaśniają następujące przykłady
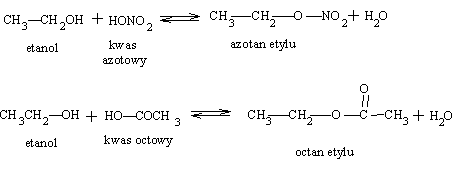
Grupę alkoholową -OH można w odpowiednich warunkach podstawić grupą aminową lub fluorowcem. W pierwszym przypadku otrzymujemy aminę, drugim fluorowcoalkan.
Podczas przepuszczania par alkoholu i amoniaku nad tlenkiem gliu lub toru tworzą się odpowiednie aminy pierwszorzędowe
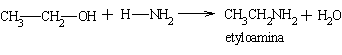
Odciągnięcie cząsteczki wody z dwóch cząsteczek alkoholu pierwszorzędowego (np. za pomocą stężonego kwasu sierkowego) prowadzi do eteru
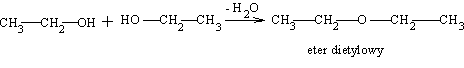
Fenole
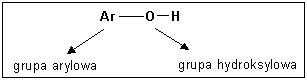
Fenole - Hydroksylowe pochodne węglowodorów aromatycznych, w których grupa hydroksylowa związana jest z atomem węgla pierścienia aromatycznego
wzór ogólny:
 przykłady:
przykłady:
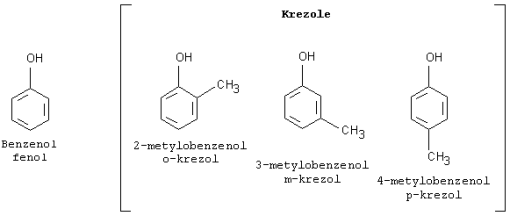
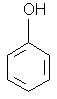 fenol - benzenol
fenol - benzenol
właściwości fizyczne fenolu:
-substancja krystaliczna o silnym charakterystycznym zapachu
-czysty bezbarwny, w obecności związków żelaza przyjmuje barwę różową albo brunatną
-powoduje trudno gojące się oparzenia, jego opary są trujące
-słabo rozpuszczalny w wodzie
właściwości chemiczne fenolu:
fenol jest słabym kwasem - ulega dysocjacji:
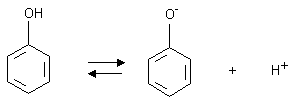
Zwiększona kwasowość fenoli w porównaniu z alkoholami wynika z oddziaływania wolnych par elektronowych atomu tlenu z sekstetem elektronowym pierścienia aromatycznego. Następuje zmniejszenie polaryzacji wiązania C-O i zwiększenie polaryzacji wiązania O-H, co ułatwia oderwanie protonu.
reakcje charakterystyczne:
1) reagują z roztworami wodorotlenków litowców dając sole - fenolany.

Fenolany jako sole słabych kwasów i mocnych zasad ulegają w wodzie hydrolizie zasadowej:
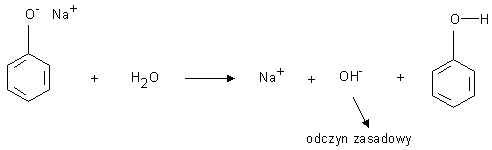
Fenol może być wyparty ze swej soli przez mocniejszy od niego kwas na przykład kwas węglowy.
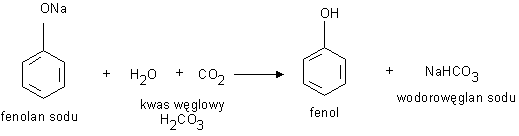
2) rekcje tworzenia barwnych związków kompleksowych z solami żelaza (III) - kolor fioletowy, granatowy lub czerwonobrunatny
3) reakcje podstawienia wodoru w pozycjach orto i para względem grupy hydroksylowej w pierścieniu aromatycznym.
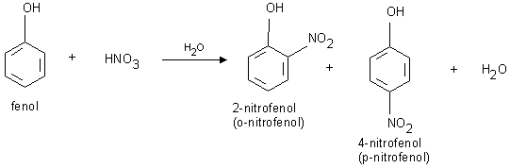
a) reakcje nitrowania fenolu (zachodzi bardzo łatwo - powstaje mieszanina orto i para nitrofenoli).
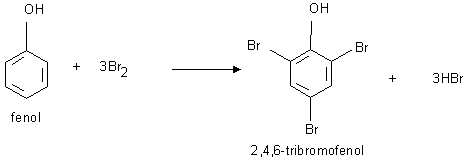
b) chlorowanie lub bromowanie fenolu Reakcja zachodzi bardzo łatwo, jest używana do oznaczania zawartości fenolu, na przykład w ściekach przemysłowych.
3) reakcja ze stężonym kwasem bromowodorowym w obecności stężonego kwasu siarkowego nie zachodzi w przeciwieństwie do alkoholi (odróżnianie fenoli i alkoholi).
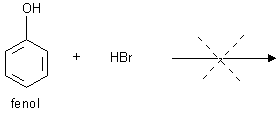
4) Reakcja uwodornienia
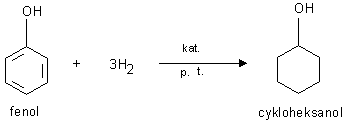
5) reakcje estryfikacji z kwasami karboksylowymi.
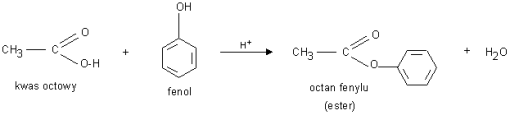
Otrzymywanie:
a) hydroliza halogenków arylowych zachodząca w bardzo ostrych warunkach (ogrzewanie ze stężonym roztworem NaOH w temperaturze ponad 370 C i pod ciśnieniem), rozkład utworzonego fenolanu kwasem węglowym.
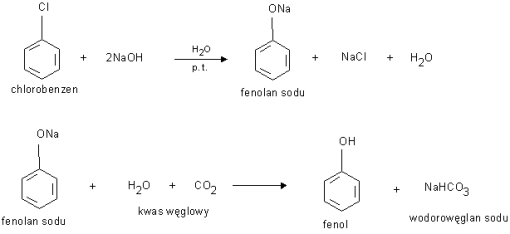
b) destylacja smoły węglowej
Zastosowanie:
-krezole są stosowane jako środki do dezynfekcji pomieszczeń sanitarnych.
Lizol - roztwór krezoli w mydle potasowym
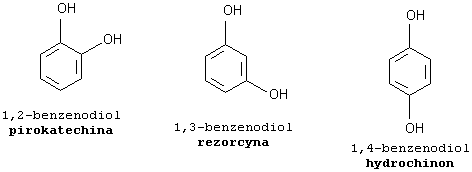
-benzodiole służą do produkcji barwników
-hydrochinon stosowany jako składnik wywoływacza fotograficznego
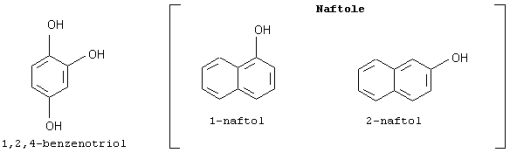
-naftole są stosowane do wyrobu barwników, leków, środków zapachowych
-fenol stosowany do produkcji tworzyw sztucznych, barwników, farb, materiałów wybuchowych wodny roztwór fenolu - karbol używany jest do dezynfekcji pomieszczeń
Darmowy hosting zapewnia PRV.PL
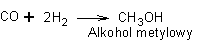
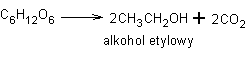
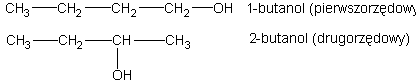
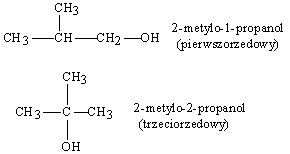

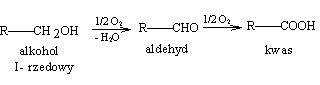

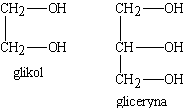


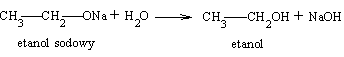
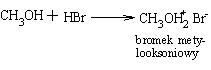
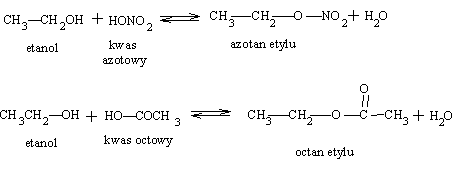
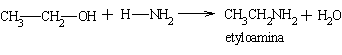
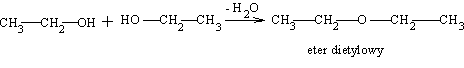




 fenol - benzenol
fenol - benzenol